如果你也在 怎样代写热力学Thermodynamics 这个学科遇到相关的难题,请随时右上角联系我们的24/7代写客服。热力学Thermodynamics是物理学的一个分支,涉及热、功和温度,以及它们与能量、熵以及物质和辐射的物理特性的关系。这些数量的行为受热力学四大定律的制约,这些定律使用可测量的宏观物理量来传达定量描述,但可以用统计力学的微观成分来解释。热力学适用于科学和工程中的各种主题,特别是物理化学、生物化学、化学工程和机械工程,但也适用于其他复杂领域,如气象学。
热力学Thermodynamics从历史上看,热力学的发展源于提高早期蒸汽机效率的愿望,特别是通过法国物理学家萨迪-卡诺(1824年)的工作,他认为发动机的效率是可以帮助法国赢得拿破仑战争的关键。苏格兰-爱尔兰物理学家开尔文勋爵在1854年首次提出了热力学的简明定义,其中指出:”热力学是关于热与作用在身体相邻部分之间的力的关系,以及热与电的关系的课题。” 鲁道夫-克劳修斯重述了被称为卡诺循环的卡诺原理,为热学理论提供了更真实、更健全的基础。他最重要的论文《论热的运动力》发表于1850年,首次提出了热力学的第二定律。1865年,他提出了熵的概念。1870年,他提出了适用于热的维拉尔定理。
热力学Thermodynamics代写,免费提交作业要求, 满意后付款,成绩80\%以下全额退款,安全省心无顾虑。专业硕 博写手团队,所有订单可靠准时,保证 100% 原创。最高质量的热力学Thermodynamics作业代写,服务覆盖北美、欧洲、澳洲等 国家。 在代写价格方面,考虑到同学们的经济条件,在保障代写质量的前提下,我们为客户提供最合理的价格。 由于作业种类很多,同时其中的大部分作业在字数上都没有具体要求,因此热力学Thermodynamics作业代写的价格不固定。通常在专家查看完作业要求之后会给出报价。作业难度和截止日期对价格也有很大的影响。
avatest™帮您通过考试
avatest™的各个学科专家已帮了学生顺利通过达上千场考试。我们保证您快速准时完成各时长和类型的考试,包括in class、take home、online、proctor。写手整理各样的资源来或按照您学校的资料教您,创造模拟试题,提供所有的问题例子,以保证您在真实考试中取得的通过率是85%以上。如果您有即将到来的每周、季考、期中或期末考试,我们都能帮助您!
在不断发展的过程中,avatest™如今已经成长为论文代写,留学生作业代写服务行业的翘楚和国际领先的教育集团。全体成员以诚信为圆心,以专业为半径,以贴心的服务时刻陪伴着您, 用专业的力量帮助国外学子取得学业上的成功。
•最快12小时交付
•200+ 英语母语导师
•70分以下全额退款
想知道您作业确定的价格吗? 免费下单以相关学科的专家能了解具体的要求之后在1-3个小时就提出价格。专家的 报价比上列的价格能便宜好几倍。
我们在物理Physical代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的物理Physical代写服务。我们的专家在热力学Thermodynamics代写方面经验极为丰富,各种热力学Thermodynamics相关的作业也就用不着说。
物理代写|热力学代写Thermodynamics代考|Analyzing Isentropic Processes
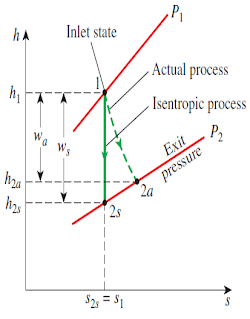
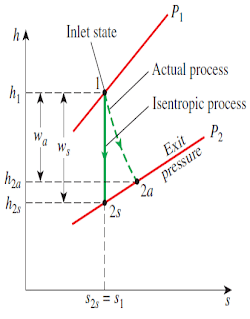
You may think that every ideal process creates a change in entropy. Believe it or not, entropy doesn’t change in some ideal processes. An ideal compression or expansion process involving an ideal gas is reversible and adiabatic, has no change in entropy, and is called an isentropic process.
You can use either the constant specific heat assumption or the variable specific heat assumption when analyzing isentropic processes, as shown in the previous section “Calculating Entropy Change.” The constant specific heat method gives satisfactory results when the temperature change isn’t large, as in simple compression/expansion processes. The variable specific heat method gives the most accurate results, especially for large temperature changes in a process. I discuss analysis of isentropic processes using both methods in the following sections.
Using constant specific heat
For an isentropic process, the change in entropy equations shown in the previous section are set equal to zero. This gives three mathematical equations to relate temperature, pressure, and specific volume to each other. One equation relates temperature to pressure, the second relates temperature to specific volume, and the third relates pressure to specific volume. These equations are as follows:
$$
\begin{aligned}
& \left(\frac{T_2}{T_1}\right)=\left(\frac{v_1}{v_2}\right)^{k-1} \
& \left(\frac{T_2}{T_1}\right)=\left(\frac{P_2}{P_1}\right)^{(k-1) / k} \
& \left(\frac{P_2}{P_1}\right)=\left(\frac{v_1}{v_2}\right)^k
\end{aligned}
$$
Because temperature appears as a ratio in these equations, you must use absolute temperatures. The variable $k$ in these equations is called the ratio of specific heats. You can calculate $k$ for an ideal gas using the following equation:
$$
k=\frac{c_p}{c_v}
$$
For air, $k$ equals 1.4 for processes that are within a few hundred degrees Celsius of room temperature. Because specific heat varies with temperature, you should calculate $k$ using the specific heats at the average process temperature. No units are associated with $k$ because it’s a ratio.
物理代写|热力学代写Thermodynamics代考|Balancing Entropy in a System
In a thermodynamic system, energy can enter, leave, or be stored within the system by heat transfer, work, and mass flow. You use an energy balance equation to keep track of the energy flow in a system. Entropy can only enter or leave a system by mass flow and heat transfer. Entropy can be generated within the system by irreversibilities. You can write an entropy balance on a system to keep track of entropy flow, as follows:
$$
\Delta S_{\text {systeme }}=S_2-S_1=S_{\text {in }}-S_{\text {cout }}+S_{\text {gen }}
$$
The entropy balance means the change in entropy of a system ( $\Delta S_{\text {sustem }}$ ) during a process equals the difference between the final $\left(S_2\right)$ and initial $\left(S_1\right)$ entropy of the system.
Entropy generation $\left(S_{\text {gen }}\right)$ includes only the entropy generated within the system; it doesn’t include entropy generated in the surroundings. If the process within the system is internally reversible, the entropy generation is zero.
Heat is a disorganized form of energy, so entropy flows with it. Entropy enters the system $\left(S_{i n}\right)$ as heat is transferred to the system. Entropy is removed from the system $\left(S_{\text {out }}\right)$ as heat is transferred from the system. You can calculate the entropy transfer by heat $\left(S_{\text {hinat }}\right)$ in a system by dividing the heat transfer through a system boundary $\left(Q_k\right)$ by the absolute temperature $(T)$ of the boundary for each heat transfer process, as shown in the following equation:
$S_{\text {lhan }} \cong \sum \frac{Q_k}{T_k}$ where $k$ is the number of boundaries
A system may have more than one heat transfer process; in fact, many systems have a heat addition and a heat rejection process.
The quality of energy decreases in every thermodynamic process as it is expended to do work. In this section, I discuss the analysis of the change in availability $\left(\Delta A_{\text {system }}\right)$ for closed systems and open systems. In a closed system, the mass of the system remains fixed, whereas in an open system, mass is allowed to flow through. The system refers to the fluid (either a liquid or a gas) that’s used in a thermodynamic process to move heat or produce work.
The decrease in avallability of a system between two states represents the maximum amount of useful work output that can be done by the system. If the availability of a system increases between the initial and final states, then it represents the minimum amount of work input required by the system. The availability between two states is independent of the type of system used, the type of process in the system, and the type of heat and work interactions with the surroundings.
热力学代写
物理代写|热力学代写Thermodynamics代考|Analyzing Isentropic Processes
你可能认为每个理想过程都会产生熵的变化。信不信由你,熵在一些理想过程中是不变的。理想气体的理想压缩或膨胀过程是可逆的、绝热的,没有熵的变化,称为等熵过程。
在分析等熵过程时,可以使用恒定比热假设或变比热假设,如前一节“计算熵变”所示。当温度变化不大时,如在简单的压缩/膨胀过程中,恒定比热法给出了令人满意的结果。变比热法给出了最准确的结果,特别是对于过程中较大的温度变化。在下面的章节中,我将使用这两种方法讨论等熵过程的分析。
使用恒定比热
对于等熵过程,上一节所示的熵方程的变化设为零。这给出了三个数学方程,将温度、压力和比容相互联系起来。一个方程把温度和压强联系起来,第二个方程把温度和比容联系起来,第三个方程把压力和比容联系起来。这些方程如下:
$$
\begin{aligned}
& \left(\frac{T_2}{T_1}\right)=\left(\frac{v_1}{v_2}\right)^{k-1} \
& \left(\frac{T_2}{T_1}\right)=\left(\frac{P_2}{P_1}\right)^{(k-1) / k} \
& \left(\frac{P_2}{P_1}\right)=\left(\frac{v_1}{v_2}\right)^k
\end{aligned}
$$
因为温度在这些方程中以比率的形式出现,所以必须使用绝对温度。这些方程中的变量$k$称为比热比。你可以用下面的公式计算$k$理想气体:
$$
k=\frac{c_p}{c_v}
$$
对于空气,当温度低于室温几百摄氏度时,$k$等于1.4。因为比热随温度变化,所以应该使用平均工艺温度下的比热来计算$k$。$k$没有单位因为它是一个比值。
物理代写|热力学代写Thermodynamics代考|Balancing Entropy in a System
在热力学系统中,能量可以通过传热、做功和质量流动进入、离开或储存在系统中。你可以用能量平衡方程来记录系统中的能量流动。熵只能通过质量流动和热传递进入或离开系统。熵可以在系统内部由不可逆性产生。你可以在一个系统上写一个熵平衡来跟踪熵流,如下所示:
$$
\Delta S_{\text {systeme }}=S_2-S_1=S_{\text {in }}-S_{\text {cout }}+S_{\text {gen }}
$$
熵平衡是指系统($\Delta S_{\text {sustem }}$)在一个过程中熵的变化等于系统最终的$\left(S_2\right)$和初始的$\left(S_1\right)$熵之差。
熵产$\left(S_{\text {gen }}\right)$只包括系统内产生的熵;它不包括环境中产生的熵。如果系统内的过程是内部可逆的,则熵产为零。
热是一种无序的能量形式,所以熵也随之流动。当热量传递到系统时,熵进入系统$\left(S_{i n}\right)$。当热量从系统中传递出去时,熵从系统中移除$\left(S_{\text {out }}\right)$。通过系统边界的热量传递$\left(Q_k\right)$除以每个传热过程边界的绝对温度$(T)$,可以计算出系统中热量传递$\left(S_{\text {hinat }}\right)$,如下式所示:
$S_{\text {lhan }} \cong \sum \frac{Q_k}{T_k}$,其中$k$是边界的数目
一个系统可以有一个以上的传热过程;事实上,许多系统都有一个加热量和一个排热量的过程。
在每一个热力学过程中,能量的质量随着做功的消耗而降低。在本节中,我将讨论对封闭系统和开放系统的可用性$\left(\Delta A_{\text {system }}\right)$变化的分析。在一个封闭系统中,系统的质量保持固定,而在一个开放系统中,质量是允许流动的。系统指的是在热力学过程中用来传递热量或做功的流体(液体或气体)。
系统在两种状态之间可用性的下降表示系统可以完成的最大有用的工作输出量。如果系统的可用性在初始状态和最终状态之间增加,那么它表示系统所需的最小工作量输入。两种状态之间的可用性与所使用的系统类型、系统中过程的类型以及与周围环境相互作用的热功类型无关。

物理代写|热力学代写Thermodynamics代考 请认准UprivateTA™. UprivateTA™为您的留学生涯保驾护航。
微观经济学代写
微观经济学是主流经济学的一个分支,研究个人和企业在做出有关稀缺资源分配的决策时的行为以及这些个人和企业之间的相互作用。my-assignmentexpert™ 为您的留学生涯保驾护航 在数学Mathematics作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的数学Mathematics代写服务。我们的专家在图论代写Graph Theory代写方面经验极为丰富,各种图论代写Graph Theory相关的作业也就用不着 说。
线性代数代写
线性代数是数学的一个分支,涉及线性方程,如:线性图,如:以及它们在向量空间和通过矩阵的表示。线性代数是几乎所有数学领域的核心。
博弈论代写
现代博弈论始于约翰-冯-诺伊曼(John von Neumann)提出的两人零和博弈中的混合策略均衡的观点及其证明。冯-诺依曼的原始证明使用了关于连续映射到紧凑凸集的布劳威尔定点定理,这成为博弈论和数学经济学的标准方法。在他的论文之后,1944年,他与奥斯卡-莫根斯特恩(Oskar Morgenstern)共同撰写了《游戏和经济行为理论》一书,该书考虑了几个参与者的合作游戏。这本书的第二版提供了预期效用的公理理论,使数理统计学家和经济学家能够处理不确定性下的决策。
微积分代写
微积分,最初被称为无穷小微积分或 “无穷小的微积分”,是对连续变化的数学研究,就像几何学是对形状的研究,而代数是对算术运算的概括研究一样。
它有两个主要分支,微分和积分;微分涉及瞬时变化率和曲线的斜率,而积分涉及数量的累积,以及曲线下或曲线之间的面积。这两个分支通过微积分的基本定理相互联系,它们利用了无限序列和无限级数收敛到一个明确定义的极限的基本概念 。
计量经济学代写
什么是计量经济学?
计量经济学是统计学和数学模型的定量应用,使用数据来发展理论或测试经济学中的现有假设,并根据历史数据预测未来趋势。它对现实世界的数据进行统计试验,然后将结果与被测试的理论进行比较和对比。
根据你是对测试现有理论感兴趣,还是对利用现有数据在这些观察的基础上提出新的假设感兴趣,计量经济学可以细分为两大类:理论和应用。那些经常从事这种实践的人通常被称为计量经济学家。
MATLAB代写
MATLAB 是一种用于技术计算的高性能语言。它将计算、可视化和编程集成在一个易于使用的环境中,其中问题和解决方案以熟悉的数学符号表示。典型用途包括:数学和计算算法开发建模、仿真和原型制作数据分析、探索和可视化科学和工程图形应用程序开发,包括图形用户界面构建MATLAB 是一个交互式系统,其基本数据元素是一个不需要维度的数组。这使您可以解决许多技术计算问题,尤其是那些具有矩阵和向量公式的问题,而只需用 C 或 Fortran 等标量非交互式语言编写程序所需的时间的一小部分。MATLAB 名称代表矩阵实验室。MATLAB 最初的编写目的是提供对由 LINPACK 和 EISPACK 项目开发的矩阵软件的轻松访问,这两个项目共同代表了矩阵计算软件的最新技术。MATLAB 经过多年的发展,得到了许多用户的投入。在大学环境中,它是数学、工程和科学入门和高级课程的标准教学工具。在工业领域,MATLAB 是高效研究、开发和分析的首选工具。MATLAB 具有一系列称为工具箱的特定于应用程序的解决方案。对于大多数 MATLAB 用户来说非常重要,工具箱允许您学习和应用专业技术。工具箱是 MATLAB 函数(M 文件)的综合集合,可扩展 MATLAB 环境以解决特定类别的问题。可用工具箱的领域包括信号处理、控制系统、神经网络、模糊逻辑、小波、仿真等。